El pH es un concepto fundamental en química que afecta a muchos aspectos de nuestra vida diaria y del medio ambiente. Entender qué es el pH, cómo se mide, y por qué es importante nos ayuda a tomar decisiones informadas sobre nuestra salud, el cuidado del medio ambiente, y el uso de productos cotidianos. En este artículo, exploraremos en profundidad todo lo relacionado con el pH, desde su definición hasta su impacto en diversas industrias y el medio ambiente.
El término pH se refiere al "potencial de hidrógeno" y es una medida de la acidez o alcalinidad de una solución. La escala de pH va de 0 a 14, donde 7 es considerado neutro. Valores por debajo de 7 indican acidez, mientras que valores por encima de 7 indican alcalinidad. Esta medida se basa en la concentración de iones de hidrógeno (H+) presentes en una solución.
La escala de pH fue introducida por el químico danés Søren Peder Lauritz Sørensen en 1909. Sørensen trabajaba en el Laboratorio de Carlsberg, y desarrolló la escala de pH para ayudar en la investigación de la fermentación de la cerveza. Desde entonces, la escala de pH se ha convertido en una herramienta indispensable en la química y muchas otras disciplinas.
El pH es crucial porque afecta las propiedades químicas y biológicas de las sustancias. En biología, por ejemplo, muchas enzimas sólo funcionan correctamente dentro de un rango específico de pH. En la agricultura, el pH del suelo puede influir en la disponibilidad de nutrientes para las plantas. En el ámbito industrial, el pH se controla rigurosamente para asegurar la calidad y estabilidad de los productos.
La escala de pH es logarítmica, lo que significa que cada unidad de pH representa un cambio de diez veces en la concentración de iones de hidrógeno. Por ejemplo, una solución con un pH de 4 es diez veces más ácida que una solución con un pH de 5. Esta escala permite una representación más manejable de las grandes variaciones en concentración de iones H+.
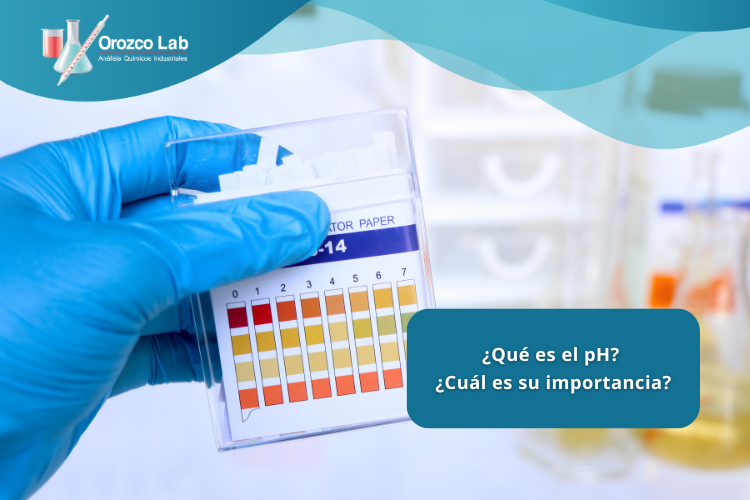
El pH puede medirse de varias maneras, desde métodos simples como el papel indicador de pH hasta instrumentos electrónicos más precisos. La elección del método depende de la precisión requerida y del contexto en el que se realiza la medición.
Estos dispositivos son precisos y fáciles de usar, proporcionando lecturas digitales del pH. Son comunes en laboratorios y aplicaciones industriales donde se requiere una alta precisión.
El papel de pH, también conocido como papel tornasol, cambia de color según la acidez o alcalinidad de la solución. Es una herramienta rápida y sencilla para obtener una estimación aproximada del pH.
Los indicadores de pH son sustancias químicas que cambian de color a diferentes valores de pH. Son útiles en experimentos de química y en situaciones donde se necesita una medición visual rápida.
El pH juega un papel crucial en la conservación y sabor de los alimentos. Por ejemplo, la acidez del vinagre (pH bajo) ayuda a preservar los encurtidos.
Los productos de limpieza a menudo tienen pH extremos para maximizar su efectividad. Los limpiadores ácidos son efectivos contra depósitos minerales, mientras que los limpiadores alcalinos son buenos para descomponer grasas.
El pH de los productos de cuidado personal debe ser compatible con el pH natural de la piel para evitar irritaciones. Por lo general, los productos para el cuidado de la piel tienen un pH ligeramente ácido.
El equilibrio del pH en el cuerpo es vital para la salud. El cuerpo humano tiene diferentes niveles de pH en distintos sistemas; por ejemplo, la sangre tiene un pH ligeramente alcalino alrededor de 7.4.
La piel humana tiene un pH ligeramente ácido, alrededor de 5.5. Este pH ayuda a mantener la barrera protectora de la piel contra bacterias y contaminantes.
El equilibrio ácido-base del cuerpo es fundamental para el funcionamiento de los órganos y sistemas. Un desequilibrio puede llevar a condiciones como la acidosis o la alcalosis, que pueden ser peligrosas.
El pH del agua es crucial para la vida acuática. La mayoría de los organismos acuáticos requieren un pH cercano a 7 para sobrevivir. Cambios significativos en el pH del agua pueden ser indicativos de contaminación.
El pH del suelo afecta la disponibilidad de nutrientes para las plantas. Suelos demasiado ácidos o alcalinos pueden limitar el crecimiento de ciertas plantas.
La contaminación puede alterar el pH de los cuerpos de agua y suelos, afectando negativamente a los ecosistemas. La lluvia ácida, por ejemplo, es un resultado de la contaminación que disminuye el pH del agua de lluvia.
Las plantas requieren un rango específico de pH en el suelo para absorber los nutrientes de manera efectiva. Algunos cultivos prefieren suelos ácidos, mientras que otros crecen mejor en suelos alcalinos.
Los agricultores ajustan el pH del suelo utilizando enmiendas como cal (para aumentar el pH) o azufre (para disminuir el pH), mejorando así las condiciones de crecimiento para los cultivos.
El pH es crucial en la industria alimentaria para controlar el sabor, la textura y la conservación de los productos. Por ejemplo, el pH del yogur debe ser controlado para asegurar su sabor y vida útil.
En la industria farmacéutica, el pH se controla para asegurar la estabilidad y eficacia de los medicamentos. Un pH inadecuado puede afectar la solubilidad y la biodisponibilidad de los fármacos.
La industria química utiliza el pH para controlar las reacciones químicas y la producción de productos. El ajuste y control del pH son esenciales para asegurar la calidad y seguridad de los procesos químicos.
El pH del agua en los acuarios debe mantenerse dentro de un rango adecuado para la salud de los peces y otras formas de vida acuática. Un pH incorrecto puede causar estrés y enfermedades en los peces.
En la acuicultura a gran escala, como en estanques de peces, el pH del agua se monitorea y ajusta regularmente para garantizar un ambiente saludable para los peces. Esto es crucial para la producción sostenible y eficiente de pescado.
El pH es un tema común en los experimentos de ciencias en las escuelas. Los estudiantes aprenden sobre ácidos y bases, y cómo medir el pH utilizando papel de pH o indicadores.
Comprender el pH es fundamental en la educación química. Los estudiantes aprenden sobre la escala de pH, cómo se mide, y su importancia en reacciones químicas y en la vida diaria.
La temperatura puede influir en el pH de una solución. A medida que la temperatura aumenta, la disociación de los iones de hidrógeno puede cambiar, alterando el pH.
La concentración de solutos en una solución también afecta el pH. Soluciones más concentradas pueden tener un pH diferente debido a la mayor cantidad de iones presentes.
El dióxido de carbono disuelto en agua forma ácido carbónico, lo que puede disminuir el pH de la solución. Este fenómeno es relevante en la química del agua y en estudios ambientales.
Para disminuir el pH de una solución, se pueden agregar ácidos como el ácido clorhídrico o el ácido sulfúrico. Esto se hace en muchas aplicaciones industriales y de laboratorio.